Chapitres
La réaction d'autoprotolyse de l'eau est un phénomène essentiel en chimie qui joue un rôle fondamental dans de nombreuses réactions chimiques.
Elle permet à l'eau de se comporter à la fois comme un acide et une base, et est à la base de l'équilibre acido-basique
Comprendre la réaction d'autoprotolyse de l'eau et le produit ionique de l'eau est crucial pour appréhender les principes de la chimie et de la réactivité chimique.
✅ Exemples concrets :
- Lorsque nous préparons une boisson acide comme le jus de citron, la concentration en ions hydronium est élevée, ce qui confère au jus son goût acidulé.
- Lorsque nous utilisons de l'eau pour nettoyer des surfaces alcalines, la présence d'ions hydroxyde aide à neutraliser les taches et à éliminer les substances grasses.
- La compréhension de l'autoprotolyse de l'eau et du produit ionique de l'eau nous permet de mieux comprendre les réactions chimiques qui se produisent dans notre vie quotidienne et d'ajuster les conditions en conséquence.

L'eau en tant qu'acide et en tant que base ?

L'eau joue un rôle essentiel en tant que solvant universel dans de nombreuses réactions chimiques. En plus de cela, elle peut également se comporter à la fois comme un acide et une base, ce qui en fait une substance unique et polyvalente.
⚛ La distinction entre l'eau en tant qu'acide et l'eau en tant que base repose sur sa capacité à libérer ou à accepter des protons (ions H+)
L'eau en tant qu'acide
L'eau en tant qu'acide se réfère à sa capacité à libérer des protons lorsqu'elle entre en contact avec une base.
Dans ce contexte, l'eau agit comme un acide de Brønsted-Lowry.
Selon la théorie de Brønsted-Lowry, un acide est une substance qui donne un proton (H+) et une base est une substance qui accepte un proton.
L'eau peut se dissocier en :
- Ions hydronium (H3O+)
- Ions hydroxyde (OH-)
- Selon l'équation d'autoprotolyse de l'eau :
- ✅ H2O + H2O ⇌ H3O+ + OH-
Dans cette réaction, l'eau agit en tant qu'acide en libérant un proton pour former l'ion hydronium (H3O+).
L'eau H2O joue le rôle d'un acide au sein du couple acide base (H2O/OH-) :
- La molécule d'eau cède un proton H+ pour former sa base conjuguée
- L'ion hydroxyde de formule OH-
- La demi-équation de réaction associée est alors la suivante :
- ✅ H2O ⇌ OH- + H
L'eau étant un acide, elle peut donc réagir avec une base B- dont la demi-équation de réaction est :
- B- + H+ ⇌ BH
Par conséquent, en assemblant les deux demi-équations de réaction, l'équation de réaction entre l'eau (en tant qu'acide) et cette base obtenue est alors : H2O + B- ⇌ OH-+ BH.
L'eau en tant que base
L'eau joue également le rôle d'une base au sein du couple acide base ( H3O+/H2O).
Dans ce cas, la molécule d'eau capte un proton H+ pour former son acide conjugué, l'ion oxonium de formule H3O+.
La demi-équation de réaction associée est alors la suivante :
- H2O + H+ ⇌ H3O+
L'eau étant une base, elle peut donc réagir avec un acide AH dont la demi-équation de réaction est :
- AH ⇌ A- + H+
Par conséquent, en assemblant ces deux demi-équations de réaction, l'équation de réaction entre l'eau (en tant que base) et cet acide qui en résulte est alors : H2O + AH ⇌ H3O+ + A-
L'eau est un ampholyte
Etant donné que, selon le couple acide-base considéré, l'eau peut jouer le rôle d'acide ou de base :
On dit qu'elle est un ampholyte
À noter qu'il existe d'autres ampholytes, comme par exemple l'ion hydrogénocarbone (HCO3-) qui joue le rôle d'un acide dans le couple (HCO3-/CO32-) et le rôle d'une base dans le couple (H2CO3/HCO3-).
En résumé, l'eau peut agir à la fois comme un acide et une base. En tant qu'acide, elle libère des protons lorsqu'elle réagit avec une base, formant ainsi des ions hydronium (H3O+). En tant que base, elle accepte des protons d'un acide, formant également des ions hydronium (H3O+). Cette dualité de l'eau en tant qu'acide et base lui confère des propriétés chimiques uniques et une importance fondamentale dans de nombreuses réactions chimiques et processus biologiques.
L'autoprotolyse de l'eau ?
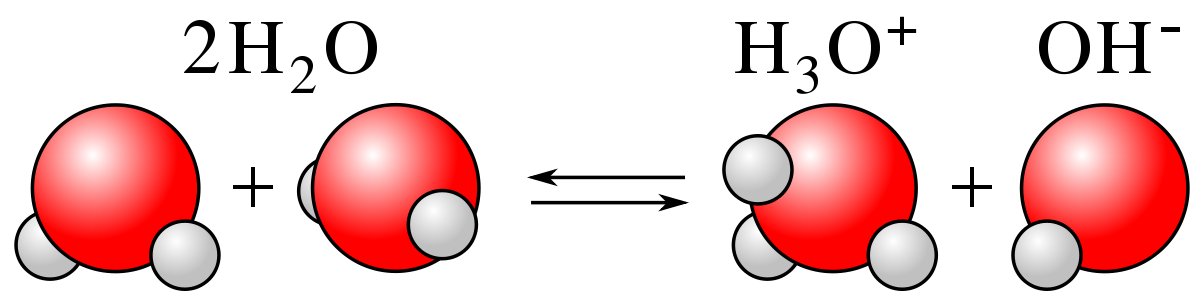
Ainsi, l'eau peut aussi bien jouer le rôle d'un acide que jouer le rôle d'une base. Comme les acides et les bases réagissent entre eux, l'eau peut donc réagir avec elle-même.
Réaction d'autoprotolyse de l'eau
La réaction d'autoprotolyse de l'eau est un processus chimique essentiel qui se produit spontanément.
Il s'agit de la dissociation des molécules d'eau en ions hydronium (H3O+) et en ions hydroxyde (OH-)
Cette réaction peut être représentée par l'équation chimique suivante :
2 H2O ⇌ H3O+ + OH-
Formation des ions hydronium et hydroxyde
Lors de l'autoprotolyse de l'eau, les molécules d'eau se transforment en ions hydronium et en ions hydroxyde. Les ions hydronium sont des ions positifs formés par la protonation d'une molécule d'eau, tandis que les ions hydroxyde sont des ions négatifs résultant de la déprotonation d'une molécule d'eau.
Constante d'autoprotolyse (Kw)
La constante d'autoprotolyse, notée Kw, est une mesure de l'équilibre entre les ions hydronium et hydroxyde dans l'eau.
À une température de 25°C, la valeur de Kw est de 1,0 x 10^-14 mol^2/L^2
Cette constante exprime le produit des concentrations des ions hydronium et hydroxyde dans l'eau à cette température.

Importance de la constante d'autoprotolyse
La constante d'autoprotolyse de l'eau revêt une grande importance en chimie.
? Elle permet de calculer la concentration des ions hydronium et hydroxyde dans une solution aqueuse, ainsi que de déterminer le pH de la solution
Le pH est une mesure de l'acidité ou de la basicité de la solution et dépend de la concentration des ions hydronium.
La constante d'autoprotolyse influence également :
- La réactivité des substances en solution
- La solubilité des composés
- La vitesse des réactions chimiques
- Et joue un rôle crucial dans de nombreux processus chimiques
Autoprotolyse et conductivité de l'eau pure
⚡️ L'eau pure est généralement considérée comme un mauvais conducteur de l'électricité en raison de sa faible concentration en ions. Cependant, en raison de la présence des ions hydronium (H3O+) et hydroxyde (OH-) résultant de l'autoprotolyse de l'eau, elle présente une légère conductivité électrique. Cette conductivité est extrêmement faible, mais elle peut néanmoins être mesurée à l'aide d'un appareil de conductivité.
La conductivité de l'eau pure dépend de la température et de la pureté de l'eau. À une température de 25°C, la conductivité est d'environ 5,5 μS/cm (microsiemens par centimètre). Cela est dû à la présence de traces de solutés dissous dans l'eau, tels que des gaz dissous ou des impuretés minérales provenant de l'environnement.
⚠️ Cependant, il est important de noter que l'eau pure peut rapidement absorber des substances dissoutes de l'environnement, ce qui augmentera sa conductivité. Ainsi, pour mesurer la conductivité de l'eau, il est préférable d'utiliser de l'eau déionisée ou de l'eau distillée de haute pureté.
Le produit ionique de l'eau

Définition du produit ionique de l'eau
L'équilibre qui existe entre l'eau et les ions produits par la réaction d'autoprotolyse de l'eau peut être caractérisé par la relation suivante : Ke = [H3O+] x [OH-] où
- Ke est une constante appelée produit ionique de l'eau.
- [H3O+] est la concentration en ions oxonium
- [OH-] est la concentration en ions hydroxyde
C'est une grandeur sans unité qui dépend de la température.
Dans l'écriture d'une constante de réaction, les concentrations des solides et des liquides purs n'apparaissent pas dans l'écriture de la constante. Pour ce qui est du cas présent, la concentration en eau n'apparaît donc pas dans l'écriture du produit ionique de l'eau.
Calcul du produit ionique de l'eau pure
Déterminons la valeur du produit ionique de l'eau pure à 25°C.
- À 25°C, le pH de l'eau pure est égal à 7.
- De plus, [H3O+] = 10-pH = 10-7 mol/L (avec pH = 7)
Dans une eau pure, les ions hydroxyde et les ions oxonium sont produits en même quantité par autoprotolyse, ce qui signifie que leurs concentrations ont la même valeur : [H3O+] = [OH-].
- Ke = [H3O+] x [OH-] => Ke = [H3O+] x [H3O+] => Ke = [H3O+]2 => Ke = 10-14
- Ainsi, à 25°C, le produit ionique de l'eau a pour valeur Ke = 10-14
C'est aussi simple que cela !
Solutions aqueuses acides, basiques et neutres
Nous avons vu plus haut qu'une solution d'eau pure à 25°C est à pH = 7 et contient des ions oxonium et hydroxyde en concentrations égales : [H3O+] = [OH-].
On dit que la solution est neutre.
- Toute solution pour laquelle [H3O+] > [OH-] est acide
- Toute solution pour laquelle [OH-] > [H3O+] est basique
Relation entre pKe, pH et pOH
D'après la formule du produit ionique de l'eau, Ke = [H3O+] x [OH-].
En appliquant un logarithme népérien de chaque côté de l'équation, on obtient la relation suivante :
- - log(Ke) = -log([H3O+] x [OH-]) = -log([H3O+]) -log[OH-])
- Compte-tenu des notations et relations suivantes :
- log(Ke) = pKe
- log([H3O+]) = pH
- log([OH-]) = pOH
On en déduit l'expression suivante : pKe = pH + pOH A 25°C, le Ke étant égal à 10-14 alors le pKe est égal à 14.
Par conséquent, la somme du pH et du pOH est toujours égale à 14 à 25°C.
⚠️ Remarque : comme dit précédemment, le Ke dépend de la température. Le pKe est donc égal à 14 uniquement à 25°C
Calcul de la concentration en ions hydroxyde OH- à partir du pH
La relation du produit ionique de l'eau va permettre par exemple de calculer la concentration en ions hydroxyde à partir du pH.
En effet, prenons l'exemple d'une solution aqueuse qui a un pH égal à 6 à 25°C.
- On sait que [H3O+] = 10-pH = 10-6 mol/L (avec pH = 6) Comme Ke = [H3O+] x [OH-],
- Alors

- Donc
 avec [H3O+] = 10-6 mol/L et Ke = 10-14
avec [H3O+] = 10-6 mol/L et Ke = 10-14 - Soit
 la concentration étant exprimée en mol/L
la concentration étant exprimée en mol/L
Calcul de la concentration en ions oxonium et déduction du pH
La formule du produit ionique de l'eau va également permettre en particulier de calculer la concentration en ions oxonium (et donc d'en déduire le pH) à partir de la concentration en ions hydroxyde.
Prenons l'exemple d'une solution aqueuse de concentration en ions hydroxyde [OH-] = 10-3 mol/L.
- Comme Ke = [H3O+] x [OH-], Alors

- Donc
 avec [OH-] = 10-3 mol/L et Ke = 10-14
avec [OH-] = 10-3 mol/L et Ke = 10-14 - Soit
 la concentration étant exprimée en mol/L
la concentration étant exprimée en mol/L - Comme [H3O+] = 10-11 mol/L = 10-pH
- Alors on en déduit que le pH de cette solution est égal à 11
Alors, est-ce que cela est clair comme de l'eau de roche pour vous ?























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Cours du produit ionique de l’eau
Bonjour Nabila ! Rendez-vous sur la plateforme de Superprof, sélectionnez la rubrique “Découvrir nos Superprofs” en indiquant le sujet de votre cours. Vous trouverez de nombreux professeurs près de chez vous. 🙂
Cet article est très intéressant
Comment savoir qu’une solution est acide, basique ou neutre si la température est différente de 25°C?
Même question
Merci
Bonjour,
Je me demandais pourquoi le produit ionique de l’eau (à 25°C) est égale à 10^-14. Est ce une valeur expérimentale ou bien une convention ? On part toujours de ce postulat, mais d’où vient il ?
J’ai vraiment aimé cette partie c’est bien vrai
Une concentration n’est pas sans unité donc un produit de concentration non plus… par conséquent le produit ionique a pour unité celle de la concentration au carré donc (mol/kg)^2…