Chapitres
- 01. Les états liquides et gazeux
- 02. L'étude de la pression dans l'histoire
- 03. Les forces pressantes dans les liquides et les gaz
- 04. Définition de la pression
- 05. Les unités de pression
- 06. Variation de pression dans un gaz ou un liquide
- 07. Influence de la pression sur la quantité de gaz dissous dans un liquide
- 08. Les instruments de mesures de la pression
- 09. Conséquences des conditions de pression sur le sportif

Les états liquides et gazeux
Les liquides et les gaz sont regroupés sous l'appellation fluide par opposition aux solides. Les fluides sont caractérisés par un ensemble de molécules en mouvement qui leur confère les particularités suivantes :
- possibilité de prendre la forme de leur contenant,
- possible d'y introduire un corps étranger.
Quel est la différence entre un liquide et un gaz ?
La "liberté" des molécules est la principale différence entre un liquide et un gaz. Dans un liquide, les molécules interagissent fortement les unes avec les autres et sont donc spatialement très proches. Dans un gaz, les molécules sont beaucoup plus éloignées et n'interagissent pas ou peu entre elles. Elles sont donc libres d'occuper tout l'espace disponible.
L'étude de la pression dans l'histoire
L'étude des gaz se développe largement au XVIIe siècle notamment grâce à :
- Evangelista Torricelli, physicien et mathématicien florentin (1608-1647) : étudie la pompe à eau de Galilée, ce qui lui permet de mettre en évidence la pression atmosphérique. En découle l'invention du baromètre à tube de mercure en 1643. Le millimètre de mercure est également appelé torr en son honneur.
- Gilles Personne de Roberval, mathématicien et physicien français (1602-1675) : il aurait effectué l'expérience décisive démontrant l'existence de pression atmosphérique.
- Blaise Pascal, mathématicien, physicien, inventeur, philosophe, moraliste et théologien français (1623-1662) : il travaille sur l'existence du vide et met en évidence en 1648 la présence de pression atmosphérique, en mesurant la pression de l'air, avec un baromètre de Torricelli, à Clermont-Ferrand et en haut du Puy de Dôme, la montagne la plus proche.
Les forces pressantes dans les liquides et les gaz
Tout corps plongé dans un fluide (liquide ou un gaz) subit de la part de ce dernier une force de poussée appelée force pressante. Cette force pressante s'exerce toujours:
- Selon une direction perpendiculaire à la surface de l'objet
- dans le sens du fluide vers l'objet
- en tout point de l'objet
La valeur de ces forces pressantes dépend de plusieurs paramètres, tels que la température, la quantité de matière, le volume de fluide...

Définition de la pression
La pression est la force pressante exercée par unité de surface.
La pression P correspond donc au rapport de la force pressante F par la surface S sur laquelle cette force s'exerce.
Ceci s'exprime par la relation suivante : 
- Avec F en newton (N),
- S en mètre carré (m2),
- P en pascal (Pa)
Calculer la valeur de la pression
Une surface de 20 cm2 subit une force pressante de 200 N.
- F = 200 N
- S = 20 cm2
- Conversion en mètre carré : S = 0,0020 m2
La pression subit par cette surface est donc de P=200/0.002 Soit une pression de 100 000 Pa
Calculer la valeur d'une force pressante
La relation précédente permet aussi de calculer la valeur d'une force pressante lorsque la valeur de la pression et celle de la surface sont connues. La relation devient : F = P x S Exemple : Une surface de 0,5 m2 subit une pression de 100 000 Pa
- P = 100 000 Pa
- S = 0,5 m2
- donc F = 100 000 x 0,5
- Soit F = 50 000 N
Les unités de pression
Historiquement, il existe de nombreuses unités pour quantifier la pression. La plupart du temps, il s'agit d'une unité de force par une unité de surface, en lien avec la définition. L'unité de mesure de pression du système international est appelée le Pascal, en hommage à Blaise Pascal. Comme la plupart des unités du système international, il est possible d'utiliser les unités dérivées : le millipascal, centipascal... Cependant, il existe de nombreuses autres unités, encore utilisées aujourd'hui, bien qu'elles n'appartiennent pas au système international. Les plus importantes sont récapitulées dans le tableau suivant :
| Unité de pression | Pascal (Pa) | Bar (bar) | atmosphère (atm) | milimètre de mercure (mmHg) ou torr |
|---|---|---|---|---|
| Equivalent en unité de force/surface | N/m2 | daN/cm2 | dynes/cm2 (dyne : unité de force g.cm/s2) | - |
| Equivalent en Pascal | - | 100 000 Pa | 101 325 Pa | 133.3 Pa |
| Pression atmosphérique | 101325 Pa | environ 1 bar | 1 atm | 760 mmHg |
| Appareil de mesure | Manomètre | Baromètre | - | Baromètre à mercure |
| Origine et utilisation | Correspondant à la définition de la pression. Utilisée en météorologie (hpa) | Plus adaptées aux fortes pressions. Utilisée en plongée sous marine, océanographie. | Correspond aux conditions de pression atmosphérique au niveau de la mer à la latitude de Paris. Equivalente à 1 bar. N'est plus très utilisée aujourd'hui | Mesurée avec un baromètre au mercure. Demeure utilisée en médecine dans certains pays (pression sanguine), ou en chimie (très faibles pressions) |
Variation de pression dans un gaz ou un liquide

Dans un fluide la pression dépend de sa nature et de de la hauteur de la couche de matière qui se trouve au dessus du corps concerné. Par exemple, dans l'atmosphère, lorsque l'altitude augmente la pression diminue car l'épaisseur d'air qui se trouve au dessus diminue. La pression de l'air passe d'1 atm au niveau de la mer à 0,32 en haut de l'Everest (8850 m d'altitude). Dans l'eau la pression augmente avec la profondeur : plus on s'enfonce sous l'eau et plus la couche d'eau qui nous recouvre est épaisse, d'où une pression plus élevée. Par exemple, à dix mètres sous l'eau la pression est d'environ 2 atm (pression atmosphérique + pression de 10 m d'eau). A noter que la pression varie plus rapidement dans l'eau que dans l'air, en raison des différences de propriétés physico-chimiques de ces deux fluides.
Influence de la pression sur la quantité de gaz dissous dans un liquide
Lorsque la température est constante, la solubilité d'un gaz dans un liquide augmente avec la pression et inversement. Ceci explique le dégazage rapide ("pschit") voire la mousse à l'ouverture de la canette de soda. En effet le récipient fermé maintient le milieu sous pression, mais dès l'ouverture, la pression revient très rapidement à pression atmosphérique. Ainsi, la solubilité du CO2 contenu dans la boisson diminue brutalement, expliquant sa libération soudaine.
Les instruments de mesures de la pression
Il existe deux appareils de mesure de pression : le baromètre qui mesure la pression atmosphérique absolue (par rapport au vide) et le manomètre qui mesure la pression dans un fluide par rapport à la pression atmosphérique. Ils sont basés sur les mêmes principes physique de fonctionnement dont voici quelques exemples :
A mercure
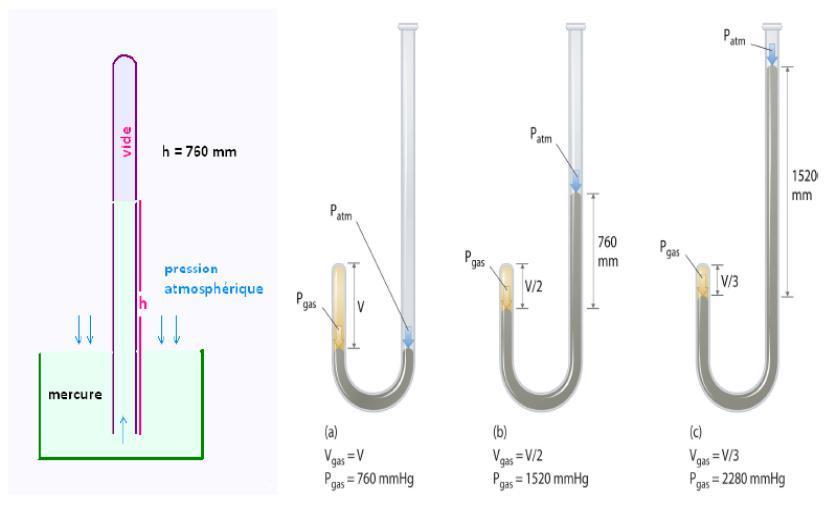
Principe de fonctionnement d'un baromètre à mercure (à gauche) et d'un manomètre à mercure (à droite). Dans un baromètre à mercure (1662) la pression atmosphérique est donnée par la hauteur de mercure dans le tube. Plus la pression atmosphérique est élevée, plus elle fait pression sur la surface de mercure à l'air libre, plus la hauteur h de mercure est importante et le vide se réduit. Inversement, si la pression atmosphérique diminue, la hauteur h s'abaisse tandis que la surface de mercure à l'air libre remonte. Cela revient à comparer la poussée du vide à celle de l'atmosphère Le principe du manomètre à mercure est identique sauf que c'est la poussée entre un fluide et l'atmosphère qui est comparée, via une différence de niveau du mercure. Ce principe de fonctionnement peut être déclinée avec différents types de liquide à la place du mercure. Ce type de manomètres se présentent sous forme de tube en U.
A gaz (1818)
C'est la mesure d'un volume de gaz qui permet de déterminer la pression du milieu. Plus la pression est élevée plus le volume est réduit et inversement à température constante.
Anéroïde (1844)
La pression est mesurée grâce à la déformation d'une capsule métallique vide d'air (baromètre) ou à pression atmosphérique (manomètre). le mécanisme est relié à une aiguille sur un cadran gradué.
Electronique
Ce sont ce que l'on appelle plus communément des capteurs de pression. La mesure est indirecte. Il existe différents principes :
- Déformation d'une capsule, membrane ou autre objet déformable.
- Variation de grandeurs électriques (résistance, potentiel, capacité...).
- Variation des caractéristiques d'une onde (longueur d'onde, fréquence de résonance...)
Conséquences des conditions de pression sur le sportif
Adaptation physiologique de l'alpiniste à hautes altitudes de faibles pressions
A haute altitude la pression est plus faible qu'au niveau de la mer. Au niveau moléculaire cela signifie que les molécules sont plus espacées les unes des autres. Pour l'alpiniste, cela impacte la quantité d'oxygène inspirée. En effet, à chaque inspiration, une plus faible quantité d'oxygène est ingérée qu'au niveau de la mer (même volume inspiré). En conséquence, la respiration et donc le rythme cardiaque s'accélère, l’essoufflement arrive plus rapidement. D'autre part, l'oxygénation des tissus est plus lente, la récupération sportive est donc plus difficile. C'est pourquoi, certains alpinistes utilisent des bouteilles à oxygène pour gravir l'Everest.
Plongée sous-marine : accident de décompression
Ce phénomène est dû aux différences de solubilité d'un gaz selon la pression. Lors d'une descente en profondeur, des quantités supérieures à la normale d'azote et de dioxygène se dissolvent dans son sang. Le dioxygène est utilisé par l'organisme (oxygénation des muscles et des tissus) tandis que le diazote, qui est un gaz inerte, s'accumule. Lors d'une remontée trop rapide, le diazote n'a pas le temps de s'évacuer par les poumons, dans lesquels il peut redevenir gazeux sans danger. Dans ce cas, le diazote forme des bulles directement dans le sang. Cela peut entraîner des conséquences éventuellement mortelles. Pour les mêmes raisons, ce plongeur ne devra également pas prendre l'avion dans les heures qui suivent la plongée. En effet, même si la cabine est pressurisée, la pression y est inférieure à celle du niveau de la mer (équivalente à 2400 m d'altitude). Après la plongée, le diazote excédentaire ne s'évacue lentement sans conséquences. Cependant, dans l'avion à plus basse pression, le taux de diazote gazeux va augmenter dangereusement. Un phénomène identique à une remontée trop rapide peut se produire.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Merci
C’est Juste pour vous dire merci pour tout ce vous œuvré pour l’évolution de l’éducation et vous demander une amitié…
J’adore vraiment votre cours parce qu’ils sont vraiment détaillés