Chapitres
- 01. Comprendre ce qu'est la mole ?
- 02. Utilité et usage de la mole ?
- 03. Exprimer une quantité de matière en mole ⚛️
- 04. Calculer une quantité matière à partir d’une masse ?
- 05. Calculer une concentration molaire ?
- 06. Calculer la quantité de matière dans une solution ?
- 07. Calculer la quantité de matière à partir de la masse volumique ?
- 08. Calculer une masse à partir d’une quantité de matière~dissolution ?
- 09. Comment déterminer expérimentalement la concentration molaire d’une solution ? ?
La mole est l’unité de quantité de matière en chimie.
? Elle correspond à un nombre d’entités (molécules, atomes, ions) qui reste toujours le même et qui, ici, est adapté à l’échelle microscopique.
? Une mole est un "paquet" de 6,02 x 1023 entités (comme une boîte d’œufs corresponds à une quantité fixe d’œufs : elle contient toujours 6 ou 12 œufs)

Comprendre ce qu'est la mole ?

Exprimé de façon plus scientifique, on peut dire que la mole, de symbole mol, correspond à l'une des unités de base du système international et est principalement utilisée en physique et en chimie suite à son adoption en 1971.
Le nombre d'entités élémentaires contenu dans une mole est appelé Constante d'Avogadro, noté Na. Il faut savoir que la valeur du nombre d'Avogadro a évolué au court du temps :
- Avant le 20 mai 2019, le nombre d'Avogadro, et donc la mole, était défini comme correspondant au nombre d'atomes de carbone dans 12 grammes (donc 10-3 kg) de carbone 12. On avait alors : NA = 6,022 140 857 . 1023 mol−1.
- Or, depuis le 20 mai 2019, le kilogramme a été redéfini. Ainsi, on fit le choix de définir le nombre d'Avogadro comme étant une constante fixée par convention. Aujourd'hui, la valeur du nombre d'Avogadro est donc : NA = 6,022 140 76 . 1023 mol−1 ce qui pourrait correspondre, en termes d'ordre de grandeur, à la quantité de grain de pop-corn nécessaire pour recouvrir la surface totale des États-Unis d'une couche uniforme et épaisse de 14 km de grains.
Il y a proportionnalité entre le nombre N d'entités élémentaires dans un échantillon et sa quantité de matière n :
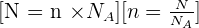
⚖️ L'ensemble des unités associées aux dimensions fondamentales constitue le système international d'unités. Il s'agit du système MksA (mètre, kilogramme, seconde, Ampère), mais le Kelvin, la mole et le candela font aussi partie de ce système. Ces unités sont appelées unités légales. Elles sont universelles et connues de par le monde entier.
? Il est important de savoir que toutes les autres dimensions se déduisent de ces sept dimensions fondamentales par produit ou division de ces dimensions.
❌ Dans certains sujets d'exercices, les grandeurs ne sont pas exprimées dans le système international mais avec des grandeurs usuelles. Il est facile de les comprendre et elles sont parfois utilisées dans la vie de tous les jours, mais il est essentiel de toujours effectuer les calculs avec les grandeurs exprimées dans l'unité internationale pour éviter les erreurs.
- Par exemple, la pression est souvent exprimée en Bar. Or, dans le système international, la pression s'exprime en Pascal !
En pratique, elle permet de dénombrer le nombre d’atomes, d’ions ou de molécules présents dans les échantillons de matière que l’on peut manipuler en chimie à l’échelle humaine (par exemple, le nombre d’atomes de NaCl (chlorure de sodium) dans un échantillon de sel)).
Par exemple:
- Un échantillon de 18,0 g d'eau est composé de 6,02 x 1023 molécules d'eau, il constitue donc une mole d'eau.
- Une mole d’atome d’hydrogène correspond à 6,02 × 1023 atomes d’hydrogène.
- Deux moles de molécules d’eau correspond 2 x 6,02 × 1023 c’est à dire 12,04 × 1023 molécules d’eau.
- Une demi mole de nucléons correspond à 0,5 x 6,02 x 1023 c’est à dire 3,01 x 1023 nucléons.
Lorsque la mole est utilisée comme unité son symbole est « mol » et on la note avec la lettre « n ».
✅ Par exemple, pour indiquer qu’il y a 2 mole de molécule dans une substance, on écrit : n = 2 mol.
Utilité et usage de la mole ?

❓ La mole est une unité qui permet d’exprimer des quantités de matière (nombre d’atomes ou de molécules...) adaptée à l’échelle microscopique
- Par exemple, la masse d’une mole d’atome de carbone est de 12 grammes
- La masse d’une mole de molécule d’eau est de 18 grammes.
- En revanche, sans utiliser l’unité « mole » on obtient des nombres beaucoup moins pratiques : la masse d’un atome de carbone est de 7,22 x 10 24 g et celle d’une molécule d’eau est de 1,20 x 1025 g. (Les puissances de dix sont particulièrement importantes et ne facilitent pas leur manipulation).
? Remarque : on pourrait utiliser la mole pour exprimer n’importe quelle quantité (comme la masse d’une personne) mais cet usage ne serait pas pertinent
La mole est une unité adaptée à l’échelle microscopique et facilite donc le décompte exclusivement dans le domaine des particules microscopiques. L’unité « mole » a d’ailleurs été inventée à partir d'un atome de base : l’atome de carbone, elle est donc bien adaptée à l’échelle microscopique.
Exprimer une quantité de matière en mole ⚛️
On utilise le nombre d’Avogadro ( noté NA ) qui correspond au nombre d’éléments dans une mole (nombre d’entités dans un paquet de « base ») :
Na = 6,02 x 1023mol-1
En général, il peut être utilisé pour exprimer un nombre d’éléments (atomes ou molécules) noté N (sans unité) en une quantité en mole notée n (en mol) à l’aide de la relation :
(1) n=N/NA
- N sans unité
- NA en Mol-1
- n en Mol
? Exemple : on considère une bouteille contenant 5,418 x 1024 molécules d’eau. On peut alors calculer le nombre de moles contenus dans la bouteille à l’aide de la relation précédente :
- Données : N = 5,418 x 1024 Na= 6,02 x 1023 mol-1
- Expression littérale : n = N/Na
- Application numérique : n = (5,418 x 1024)/(6,02 x 1023)= 9 mol
- La quantité de moles de molécule d’eau dans la bouteille est donc de 9 mol.
Remarque : On voit bien ici pourquoi on utilise l’unité « mole » : on passe d’un nombre important avec une puissance de dix à un simple chiffre, ce qui est, sans aucun doute, davantage pratique.
Calculer une quantité matière à partir d’une masse ?
La masse d'une mole d'atomes est appelée masse molaire atomique, noté M et d'unité g / mol. En chimie, on ne compte pas en nombre d'ions ou d'atomes mais en nombre de paquets, un paquet s'appelle une mole (mol).
- Une mole contient 6,02 . 1023 entités
- Le nombre de masse d’un atome correspond au nombre de nucléons qu’il contient
- Il s’agit donc de la somme du nombre de protons et du nombre de protons qui constituent le noyau de l’atome.
- La masse molaire correspond aussi au nombre de nucléons dans le noyau. A = 59, signifie qu'il y a 56 nucléons dans le noyau (et 59 grammes dans une mole)
??? Dans le tableau périodique, la masse molaire est souvent différente de A à cause des isotopes. Des isotopes sont des atomes qui possèdent le même nombre de protons mais un nombre différent de neutrons.
La masse molaire atomique d'un élément chimique ( M en g.mol-1), qui est la masse d'une mole d'atomes de cet élément permet de lier la quantité de matière ( n ) et la masse par la relation suivante :
(2) n = m/M
? Exemple : on peut déterminer la quantité de matière d'un échantillon de 36 g d'eau (H2O) :
- Données : m = 36,0 g M(H2O) = 18,0 g *
- Expression littérale : n = m/M
- Application numérique : n = 36,0 / 18,0 = 2,0 mol
- La quantité de matière d’un échantillon de 36 g d’eau est donc de 2,0 mol.
On rappellera que l’on peut déterminer la masse molaire de l’eau à partir du tableau périodique des éléments.
Calculer une concentration molaire ?

? Tout comme la concentration massique, la concentration molaire est utilisée essentiellement pour des solutions et permet d’exprimer la proportion de soluté dissous en solution. Elle correspond à la quantité de matière d’une solution par unité de volume.
? Elle s’exprime donc en mol.L-1 (ou en mol.m- 3)
La concentration molaire d’une espèce chimique A se note [A] ou cA.
Pour calculer la concentration molaire d’une solution de volume V et comportant une quantité de matière n de soluté, il suffit d’effectuer le rapport de la quantité de matière par le volume. Ce qui peut se traduire par la relation suivante:
(3) c=n/V
- n en mol
- V en L
- c en mol.L-1
? Exemple : on prépare une solution avec 2 mol de saccharose que l’on dissout dans 500 mL d’eau. On peut alors déterminer la concentration molaire à partir de la relation précédente :
On a :
- Données : V = 500 mL = 0,5 L
- n= 2 mol
- Expression littérale : c = n/V (3)
- Application numérique : c = 2/0,5 mol.L-1 = 4 mol.L-1
- La concentration molaire de la solution est de 4 mol.L-1.
Procéder à une dilution pour diminuer la concentration molaire
?? La dilution correspond à un procédé qui consiste en l'obtention d'une solution finale qui présentera une concentration inférieure à la concentration de la solution de départ. Il est alors possible de procéder à cela grâce à un ajout de solvant ou encore en prélevant une partie de la solution puis de compléter jusqu'à atteindre le volume souhaité avec du solvant.
Il est alors possible de caractériser une dilution par son taux de dilution. Mais pour cela, il est nécessaire de présupposer que le corps dilué est soluble dans le solvant qui est utilisé.
Dilution par ajout de solvant
On note la concentration d'une solution C et il est possible de la calculer avec la formule suivante :

Avec :
- C la concentration molaire. Cette unité s'exprime en mol.L-1 ;
- n la quantité de matière du soluté en solution. Cette unité s'exprime en mol ;
- Et V le volume de solvant. Cette unité s'exprime en L.
Ainsi, si on procède à une dilution par ajout de solvant, la solution initiale et la solution finale contiennent autant de quantité de soluté. Cela signifie alors que ninitiale = nfinale .
On a alors les relations suivantes qui se dégagent :
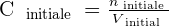

On peut déduire de ces relations le rapport suivant :
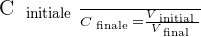
Le taux de dilution
Il est possible d'exprimer le taux de dilution avec la relation suivante :
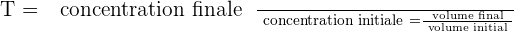
Il est important de savoir que le taux de dilution, noté T, est une grandeur sans unité et qui présente obligatoirement une valeur positive et inférieure à 1.
Quant au taux de dilutions successives, il correspond au produit des taux de dilution de chaque dilution.
Exemple
Si on procède à une dilution à 3 % puis à 5 %, on a T qui est égal à :

Calculer la quantité de matière dans une solution ?
Si l’on connaît la concentration molaire (c) d’une solution aqueuse alors il est possible d’en déduire la quantité de matière (n) qu’elle contient.
En effet, la relation (3) devient :
(4) n=cxV
- n en mol
- V en L
- c mol.L-1
? Exemple : on considère une solution aqueuse de volume 3 L et de concentration molaire c = 0,4 mol.L-1. On peut déterminer la quantité de matière de cette solution à partir de la relation précédente :
On a :
- Données : V = 3 L
- c = 0,4 mol.L-1
- Expression littérale : n = c x V (4) Application numérique : n = 0,4 x 3 mol = 1,2 mol
Cette solution contient donc 1,2 mol de soluté.
Calculer la concentration molaire à partir de la concentration massique
Il est possible de calculer la concentration molaire d’un solution à partir de sa concentration massique si la masse molaire (M) du soluté est connue à partir de la relation suivante :
(5) cm= c x M
- Cm en g.L-1
- M en g.mol-1
- c en mol.L-1

⚠️ À noter :
- On rappelle que « cm » désigne la concentration massique, « c » la concentration molaire et « M » la masse molaire
- En cas de doute, on pensera à s’assurer de l’homogénéité de l’expression numérique à partir d’une analyse dimensionnelle en unité SI (système international)
- La concentration molaire d’une solution peut aussi être mesurée directement à partir de la loi de Beer-Lambert
À partir des dimensions de la partie droite de l’égalité (4), on vérifie : g/mol x mol/L = g/L
L’expression numérique est donc bien homogène.
Exemple
Pour prévenir la déshydratation, on peut effectuer des injections de solution aqueuse de fructose de formule C6 H12 O6 de masse molaire 180 g.mol-1.
De telles solutions sont obtenues en dissolvant une masse m = 25,0 g de fructose pour obtenir un volume V = 500 mL de solution.
On peut déterminer la concentration molaire de ces solutions en fructose : On procède en deux étapes :
- On détermine d’abord la concentration massique :
- Données : V = 500 mL = 0,5 L m = 25,0 g
- Expression littérale : cm = m/V
- Application numérique : cm= 25/0,5 g.L-1= 50 g.L-1
La concentration massique en saccharose de la solution est donc de 50 g.L-1.
- On peut maintenant déterminer la concentration molaire à partir de la relation précédente (5) :
- Données : cm= 50 g.L-1
- M = 180 g.mol-1
- Expression littérale : cm= c x M c = cm/M
- Application numérique : c = 50/180 mol.L-1 = 0,278 mol.L-1
La concentration molaire en fructose de ces solutions est donc de 0,278 mol.L-1.
Calculer la quantité de matière à partir de la masse volumique ?
L’expression établit une relation entre la quantité de matière et la masse
La masse volumique, comme l’indique son nom, s’exprime à partir d’une masse et d’un volume
✅ On peut donc établir une relation entre la quantité de matière et la masse volumique
On établit en premier lieu la relation permettant de déterminer la masse m d’un corps à partir du volume V qu’il occupe et de sa masse volumique ρ :
(6) m=Vxρ
On a donc l’expression de la masse à partir de la masse volumique. On peut donc aisément établir une relation entre la quantité de matière (qui elle s’exprime à partir de la masse (2)) et la masse volumique :
(7) n = ρ xV / M
? Exemple : on peut déterminer la quantité de matière d’un échantillon de 20mL d’éthanol, de formule brute C2H6OC2H6O, à partir de sa masse volumique.
- Données : Masse volumique de l'éthanol : ρC2H6O=789 g.L−1
- Masse molaire de l’éthanol : MC2H6O = 2×MC+6×MH+MO = 2×12,0+6×1,00+16,0 = 46,0 g.mol−1
- Expression littérale : n = ρ x V / M
- V = 20 mL = 0,02 L
- Application numérique : n = 789,0 x 0,02 / 46,0 = 0,34 mol
- La quantité de matière d'éthanol dans un échantillon de 20 mL est donc de 0,34 mol.
Ce qu'il faut savoir sur la masse volumique
La masse volumique d'un échantillon est le rapport de la masse m de cet échantillon à son volume v. (ρ est la masse volumique)
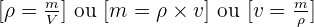
La densité d'un liquide est égale au quotient de la masse d'un volume v par la masse d'un même volume d'eau. (la densité s'exprime sans unité)
Définition du volume
Selon le domaine dans lequel ce mot est utilisé, la définition peut être différente. Mais, dans tous les cas, le volume représente une grandeur qui permet la mesure de l'extension d'un objet ou d'une partie de l'espace.
- En sciences physique, le volume d'un objet permet de mesurer l'extension dans l'espace physique que celui-ci possède et ce dans les trois directions de façon simultanée et de façon similaire à l'aire d'une figure dans le plan qui, quant à elle, mesure l'extension que celle-ci possède dans deux directions de façon simultanée
- En mathématiques, le volume d'une partie de l'espace géométrique correspond à sa mesure dans le sens de la théorie de la mesure de Lebesgue
Il peut être intéressant de connaître la notion de volume afin de déduire la masse d'un objet défini grâce notamment à la bien connue masse volumique !
Définition de la masse
? En physique, la masse correspond à une grandeur physique positive et intrinsèque d'un corps
De façon plus précise, en physique newtonienne, la masse correspond à une grandeur extensive. Cela signifie alors que la masse d'un corps formé de parties correspond à la somme des masses de ces différentes parties qui le compose.
De plus, il est essentiel de noter que la masse est une grandeur conservative. De ce fait, elle reste constante dans le cas d'un système isolé qui n'échange donc pas de matière avec son environnement.
Pour une espèce donnée, la masse m, la quantité de matière n et la masse molaire M sont liés par :
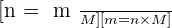
Les propriétés
La masse peut se manifester au travers de deux propriétés fondamentales :
- En mécanique statique, la masse est correspond à l'un des premières grandeurs facilement mesurables par les gens via le système de pesée puisque celle-ci permet de comparer la masse de l'objet défini avec une masse étalon connue. On appellera alors ce système la masse pesante. C'est ainsi qu'on liera la quantité de matière d'un corps à sa masse
- En mécanique dynamique, la masse correspond à une grandeur qui intervient dans le principe fondamental de la dynamique comme étant la résistance de la matière au changement de vitesse. En effet, plus la masse d'un corps est importante, plus il faudra exercer une force importante pour modifier la direction ou encore sa vitesse. On appelle alors ce phénomène "masse inerte".
Ainsi, cet aspect de la masse présente un rôle essentiel dans tous les domaines de la dynamique puisqu'elle correspond à une notion présente dans grand nombre de relations de physique classique ou encore dans les calculs qui permettent de les définir.
En effet, il est possible de constater une proportionnalité entre la masse inerte et la masse pesante et cela de façon totalement indépendante de la nature du matériau mis en jeu. Cela permet alors de prendre la même unité pour la masse pesante et la masse inerte et donc de pouvoir les définir comme étant égale. Ainsi, cette équivalence a permis de définir un principe d'équivalence.
L'unité
L'unité de masse est le kilogramme dans le Système international d'unités (S.I.). Comme pour le litre il existe des sous-unités : kg ; hg ; dag ; g ; dg ; cg ; mg.
⚠️ Attention à ne pas faire comme une majorité et confondre la masse avec le poids. En effet, dans le vocabulaire de la physique, le poids correspond à la force exercée par la gravité sur un corps pesant.
La masse de l'objet dépend de la densité de l’objet mais également du volume
A noter que déclarer que 1 Litre pèse 1 Kilogramme est totalement faux. En effet, un litre d'huile pèse 800 g et non pas 1 kg.
Calculer une masse à partir d’une quantité de matière~dissolution ?
En particulier lors des manipulations de solutions en chimie, il peut s’avérer utile de pouvoir déterminer une masse partir d’une quantité de matière (par exemple, pour une dissolution, on doit déterminer la masse de soluté à dissoudre).
Pour cela, Il suffit de manipuler l’égalité de l’expression (3) :
(8) m=nxM
? Exemple : on cherche à préparer 250 mL d'une solution de glucose de concentration 2,0×10−1 mol.L−1. On doit déterminer quelle masse de soluté on doit prélever pour la réaliser.
Données : (on a comme données le volume de solution que l’on veut préparer et la concentration qu’on veut qu’elle ait en glucose : on a donc d’après la relation (2) la quantité de matière de glucose que l’on veut obtenir en solution (attention : on a la quantité de matière en mol à partir de l’expression (2) : on ne sait donc pas combien de soluté il faut prélever ! Il nous faut la masse de soluté à prélever en grammes ! (Que l’on pourra prélever à l’aide d’une balance))
- Mglucose = 180,0 g.mol-1
- c = 2,0×10−1 mol.L−1
- V = 250 mL = 0,250 L
Grâce aux deux dernières données et à (2) (n=cxV), on a : n = 2,0 x 10-1 x 0,250 = 0,05 mol
Expression littérale : m = n x M (8) Application numérique : m = 0,05 x 180 = 9 g
La masse de soluté à dissoudre pour obtenir la solution de glucose voulue est donc de 9 g.
Réaliser la dissolution
Matériel :
- Coupelle
- Balance
- Entonnoir
- Fiole jaugée de 250 mL
Protocole :
- Poser la coupelle sur la balance.
- Tarer la balance.
- Peser les 9 g de soluté prélevés à l’aide d’une spatule.
- Rincer la fiole jaugée et l’entonnoir à l’eau distillée.
- Introduire le soluté dans la fiole jaugée à l’aide d’un entonnoir.
- Rincer le récipient et l’entonnoir à l’eau distillée et récupérer l’eau de rinçage.
- Remplir la fiole jaugée à moitié avec de l’eau distillée.
- Agiter jusqu’à dissolution complète du solide.
- Compléter la fiole avec de l’eau distillée jusqu’à ce que le bas du ménisque soit au niveau du trait de jauge.
- Boucher puis retourner deux fois la fiole jaugée afin d’homogénéiser le mélange.
- La solution est prête !
? La dissolution s'effectue dans une fiole jaugée de volume égal à celle de la solution à préparer.
Comment déterminer expérimentalement la concentration molaire d’une solution ? ?

Échelle de teinte
❌ Cette méthode de détermination d’une concentration molaire est approximative et n’est réalisable que pour des solutions colorées ! Elle permet d’obtenir un encadrement plus ou moins précis de la concentration de la solution étudiée mais ne donne pas une valeur exacte !
Cette méthode est relativement simple mais nécessite d’avoir une solution colorée et des échantillons de solutions contenant la même espèce chimique que celle de la solution étudiée de concentration connue.
Elle consiste à obtenir un encadrement de la valeur de la concentration d’une certaine solution. Pour cela :
- On aligne une série de tubes à essai contenant des solutions avec la même espèce chimique mais avec des concentrations croissantes
- On compare à l’œil nu la couleur de notre solution de concentration inconnue aux différents tubes à essai
- On place notre tube entre les deux solutions intermédiaires
- Ces dernières nous indiquent donc logiquement un encadrement de la concentration de notre solution !
Dosage
Il existe différents types de dosages s’appuyant chacun sur des propriétés physiques ou chimiques spécifiques, permettant de déterminer la concentration molaire d’une espèce en solution : dosage pH-métrique, conductimétrique...
Qu’est-ce qu’une dilution ?
?Une dilution aqueuse, comme son nom l’indique, consiste à ajouter de l’eau distillée à une solution donnée. Elle a pour effet de diminuer la concentration de la solution sans modifier la quantité de matière totale qu’elle contient.
Comment est-ce possible ? Vous connaissez déjà l’explication ! Elle se trouve dans la relation (2) que vous avez déjà rencontrée :
c=n/V
On peut se demander comment, selon cette relation, diminuer la concentration d’une solution donnée ? D’après l’égalité, on a deux solutions (puisque la concentration dépend de deux grandeurs : la quantité de matière et le volume) :
- diminuer la quantité de matière (Si n diminue, c diminue) ou
- augmenter le volume (Si V augmente, c diminue : attention : V est au dénominateur !)
Exemple :
- On prend une solution de glucose de concentration 8 mol.L-1 (c1) contenant une quantité de matière en glucose de 2 mol
- Cette solution (mère) est contenue dans une fiole de 250mL (V1)
- On suppose que l’on introduit la solution dans une fiole de 500mL (V2) et qu’on y ajoute de l’eau distillée jusqu’à atteindre 500mL
- On a ainsi doublé le volume de la solution de glucose (on passe de 250mL à 500mL) mais la quantité de matière de la nouvelle solution est toujours de 2 mol ! (On n’a pas ajouté de glucose)
- Cependant, d’après la relation (2), on a pour la nouvelle solution obtenue après dilution (solution fille) :
C2 = n / V2 = 2 / 0,5 = 4 mol.L-1
Ainsi, la concentration de la nouvelle solution est de 4 mol.L-1.
Ce résultat est prévisible ! En effet, on a doublé le volume de la solution, ce qui d’après la relation revient à diviser par 2 la concentration :
C2 = n / 2xV1,
Or, on a : c1 = n/V1 (*)
Donc, on a, En remplaçant c1 dans l’égalité (*): C2 = c1/2
Ainsi, En ajoutant de l’eau distillée, on a diminué la concentration de la solution mère : c’est ce qu’on appelle une dilution.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Merci beaucoup, cet article est fortement élaboré.
Comment peut-on savoir calculer le nb de mol sans avoir le volume seulement la masse molair
Super 🤩mnt j’ai bien compris 👍
Bonjour, pour toute aide aux devoirs veuillez contacter directement nos professeurs de physique-chimie 🙂
Quelle ressemblance existe t-il entre l’aluminium (Al3*) et l’un de ces corps : Fer,Carbone, l’azote, l’hélium ,le chlore?
Merci