Chapitres
- 01. Qu'est-ce qu'un atome ? 🪐
- 02. La structure de l'atome ⚛️
- 03. Représenter un atome sous forme symbolique 💥
- 04. Caractéristiques de l'atome 💭
- 05. Étude de la masse d'un atome à l'aide d'un spectromètre de masse 🔖
- 06. Masse des constituants d'un atome ⚖️
- 07. Calcul de la masse d'un atome 🏋️♂️
- 08. Atomes, entre défauts de masse et énergie de liaison 💥
- 09. Atomes et transformations 🔬
- 10. L'utilisation des atomes dans le cadre du nucléaire ☢️
La masse atomique est l'un des concepts fondamentaux de la chimie moderne. Elle joue un rôle essentiel dans la compréhension de la structure de la matière et de ses propriétés.
⚛️ La masse atomique représente la masse d'un atome ou d'un isotope relatif à l'unité de masse atomique unifiée (uma) :
- Elle est calculée en prenant en compte les proportions des isotopes présents dans un échantillon
- La mesure précise de la masse atomique nécessite l'utilisation de techniques sophistiquées telles que la spectrométrie de masse
Découvrez tout ce qu'il y a à savoir sur la masse des atomes ! 👇

Qu'est-ce qu'un atome ? 🪐

🤓 Le mot atome vient du grec « atomos » qui signifie insécable
En effet, pour les scientifiques de l’Antiquité, les atomes représentaient la plus petite unité de matière.
On sait de nos jours que l’atome n’est pas une particule élémentaire et qu’il peut donc être divisé.
L’atome est formé :
D’un noyau (composé de protons chargés positivement, de neutrons qui sont des particules non chargées)
Autour duquel gravitent des électrons qui sont des particules chargées négativement
👉 Le nombre d’électrons ou de protons détermine les caractéristiques physiques et chimiques de chaque atome.
Historique de l'atome
Dans l’Antiquité, la théorie d’Aristote selon laquelle la matière était formée de quatre éléments, à savoir la terre, le feu, l’air et l’eau.
C’est Leucippe et son disciple Démocrite (entre -460 et -370 av JC) qui expliquent que la matière est composée d’éléments indivisibles.
📚 Le concept de l’atome est né
Il faut ensuite attendre le XVIIème siècle avec le chimiste anglais Robert Boyle pour que l’étude de l’atome fasse un bond en avant. En effet, le scientifique propose que la matière est faite de substances simples appelées éléments.
Au siècle suivant, Antoine-Laurent Lavoisier édicte sa célèbre loi de la conservation de la matière « rien ne se perd, rien ne se crée, mais tout se transforme »
Au début du XIXème siècle, John Dalton fonde sa théorie atomique, qui ne remporte alors que peut de succès.
🔎 C’est Sir Joseph John Thomson qui fit faire un énorme bond dans l’histoire de l’atome, en découvrant les électrons. Le physicien anglais reçut un Prix Nobel en 1906 pour ses travaux sur la conduction de l’électricité par les gaz.
C’est Ernest Rutherford qui propose un modèle atomique très complet : il obtint lui aussi un prix Nobel de chimie pour ses découvertes sur la structure atomique.
Niels Bohr modifia quelque peu ce modèle et reçut lui aussi un prix Nobel (mais en physique) pour ses travaux sur la composition de l’atome.

Erwin Schrödinger appliqua ensuite les théories quantiques au modèle atomique en précisant que le nuage électronique était caractérisé par une probabilité de présence.
La structure de l'atome ⚛️
L'atome a une structure particulière, les scientifiques sont passés par différents stades avant d'arriver à décrire celle-ci.
✅ Le noyau d'un atome est constitué de protons et de neutrons, il est donc électriquement positif
Ce noyau est entouré d'électrons qui gravitent autour de celui-ci, la partie la plus extérieure de l'atome est donc électriquement positif. Dans le cas d'un atome, ces deux parties électriques se compensent et donnent un atome électriquement neutre, ce n'est pas forcément le cas pour les ions. Ces deux parties sont séparées par du vide. En effet, on dit souvent de l'atome qu'il a une structure lacunaire. De plus, la taille du noyau est très petite comparé à celle de l'atome entier.
🏝️ Imaginez un banc de sable vu de loin, on ne peut pas distinguer les grains qui le constitue. On peut les voir seulement en s'approchant de très près. La matière qui nous entoure est également constituée de petits grains de matière appelés atomes, ils ne peuvent être observés ni à l'œil nu, ni avec les microscopes optiques conventionnels.
Comme il existe plus d'une centaine d'atomes différents, on attribue un symbole à chaque atome de même nature. Il commence toujours par une lettre majuscule suivie parfois d'une lettre minuscule.
🌈 Pour mieux visualiser ces atomes invisibles à notre œil, on utilise souvent un modèle qui représente les atomes courants sous la forme de boules colorées, à chaque atome correspond une couleur.
Représenter un atome sous forme symbolique 💥

✍🏼 Afin de représenter le noyau et l’atome de façon symbolique :
- On peut utiliser le symbole chimique noté X
- A correspond au nombre total de nucléons, c’est-à-dire aux protons et aux neutrons additionnés. On parle aussi du nombre de masses
- Enfin, Z correspond au numéro atomique. Il correspond également au nombre de protons
Le symbole chimique d’un atome correspond à une ou deux lettres issues du nom entier de l’élément représenté. Ce X peut correspondre par exemple :
- à H pour l’hydrogène
- à C pour le carbone
- à Fe pour le fer
- à Mg pour le magnésium
⚠️ Note : S’il y a deux lettres, la première est toujours en majuscule, et la seconde en minuscule.
La symbolique permet de connaître le nombre de nucléons, de neutrons, de protons et d’électrons d’un atome
À partir du modèle AZX présenté ci-dessus, on peut déterminer, pour un atome donné :
- Le nombre de nucléons
- De neutrons
- De protons
- D’électrons
Z correspond au nombre de protons, et donc également au nombre d’électrons puisqu’il doit y avoir autant de protons (charges positives) que d’électrons (charges négatives) dans un atome afin qu’il soit électriquement neutre.
👉 Le nombre de neutrons, noté N, peut être déduit en calculant la différence entre le nombre de nucléons et le numéro atomique (= nombre de protons) : N = A - Z.
On peut ainsi retenir que :
- Le nombre de protons = numéro atomique = Z
- Le nombre d’électrons = nombre de protons donc = numéro atomique = Z
- Le nombre de nucléons = A – Z
Exemple : pour un atome de carbone classique il y a :
- A = 12 nucléons = 12 masses ;
- Z = 6 protons.
Un atome étant toujours électriquement neutre, il doit avoir autant d’électrons que de protons, on en déduit ainsi que l’atome de carbone a 6 électrons. Enfin, il y a A-Z neutrons, c’est-à-dire 6 neutrons en l’occurrence.
⚠️ Note : Les atomes contiennent souvent un nombre de neutrons proche du nombre de neutrons, voire égal, afin d’avoir une structure stable, mais il faut faire attention car ça n’est pas toujours le cas.
Exemple : Le noyau de l’uranium est composé de 92 protons (et donc d’autant d’électrons) et de 138 neutrons.
Caractéristiques de l'atome 💭
L’atome n’a pas de forme propre, ses « contours » sont finalement définis par la présence du nuage électronique. Cependant, pour des facilités d'apprentissage, on schématise souvent l'atome de manière sphérique.

Taille : les atomes ont un ordre de grandeur de 10-10m. La création de microscopes à sonde locale à permis d’étudier les atomes.
Le saviez-vous ? L’atome d’hydrogène est l’atome le plus petit en taille, il possède un diamètre de 5 10-11 m.
L’atome de radium est, quant à lui, l’atome le plus grand puisqu’il possède un rayon atomique de près de 4.3 10-10 m !
Masse : les atomes possèdent un volume et une masse très faible. On considère qu’un proton et qu’un neutron possèdent à peu près la même masse.
Charge : les électrons sont chargés négativement et possèdent une charge estimée à qe = -1,6022.10-19 C. Les protons sont quant à eux chargés positivement et possèdent un charge de 1,6022.10-19 C. Enfin les neutrons ne possèdent pas de charge (charge nulle).
Le tableau ci-après résumé les différentes caractéristiques d'un atome (masse et charge de ses constituants l'électron, le proton et le neutron) :
| Charge de l'électron | qe = -1,6022.10-19 C |
|---|---|
| Masse de l'électron | me = 9,1095.10-31 kg |
| Charge du proton | qp = 1,6022.10-19 C |
| Masse du proton | mp = 1,6726.10-27 kg. |
| Charge du neutron | qn = 0 C |
| Masse du neutron | mn = 1,6749.10-27 kg. |
Note : la science qui étude les caractéristiques de l'atome se nomme l'atomistique.
Pour estimer la masse du noyau, il faut donc connaître le nombre de nucléons. C’est un calcul approximatif mais qui donne un ordre de grandeur. On peut néanmoins utiliser une méthode plus précise pour calculer la masse d’un atome : le spectromètre de masse.
Étude de la masse d'un atome à l'aide d'un spectromètre de masse 🔖
Le spectromètre de masse est un procédé d’analyse physico-chimique par mesure de la masse des éléments. Voici son fonctionnement séquentiel :
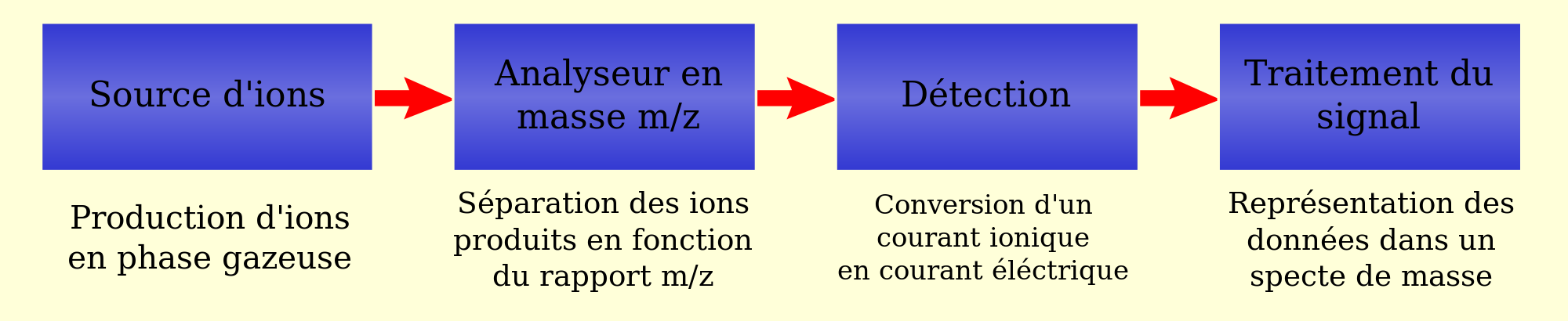
Le spectromètre de masse a été mis au point par Joseph John Thomson. Il est composé d’une source d’ionisation qui permet de vaporiser les molécules et à les ioniser.
- Les ions sont ensuite séparés en fonction de leur rapport masse/charge (m/z) dans un analyseur
- Le détecteur permet ensuite de convertir les informations en signal électrique (le courant est proportionnel au nombre d’ion) enfin le signal obtenu est amplifié et traité pour qu’il soit analysable
Presque simple comme bonjour !
Masse des constituants d'un atome ⚖️
Comment a-t-on calculé la masse des nucléons et de l’électron ?
🧮 Le problème qui s’est posé aux scientifiques à été le suivant : la masse d’un atome et de ses nucléons est extrêmement faible.
Ils ont dû ainsi convenir d’une unité de masse atomique. Plusieurs atomes ont servi de gamme étalon mais c’est l’atome de carbone qui a été choisi au final.
On utilise l’unité de masse atomique unifiée (u) pour déterminer la masse des nucléons et des électrons. On appelle aussi cette unité le dalton en référence au célèbre scientifique qui étudia la théorie atomique.

Sa valeur est obtenue expérimentalement en prenant le 1/12 de la masse d’un atome 12C.
Ainsi, un atome de 12C possède :
- Une masse de 12u
- Une mole d’atome possède 12g
Note : 1 mole d'atomes contient un nombre d'atomes égal au nombre d'Avogadro Na : 6,02. 1023 mol-1
1 u vaut approximativement 1,660 538 921 × 10−27 kg1
✅ En d'autres termes : la mole est la quantité de matière d'un système contenant autant d'entités élémentaires qu'il y a d'atomes de carbone dans 12 grammes de carbone. Ce nombre d'atomes est le nombre d'Avogadro Na= 6,022.1023 mol-1.
Depuis les années 1960, on utilise comme référence le 1/12 de la masse d’un atome de carbone. D’autres modèles ont été essayées (comme le 1/16 de l’atome d’oxygène) mais c'est celui qui perdure. Attention, cette valeur étant expérimentale, elle n’apparaît pas dans le système international (SI).
Bon à savoir : Le CODATA (Comité de données pour la Science et la Technologie) recommande depuis 2006 d’utiliser cette approximation :
mu = 1.660 538 782 (83) x 10 -27 kg
Explications
L'unité de masse atomique est donc définie par le 1/12ème de la masse de l'atome de carbone :
1u = m(atome de carbone)/12
On montre ensuite que 1u = 1/Na(nombre d'Avogadro), exprimée en g
Si on veut en kg , la relation sera la suivante : 1u = 10-3/Na = 1.6606.10-27k
Note : la masse des atomes varie approximativement entre 10-27kg et 10-25kg.
🧪 Le saviez vous ? En biologie, l'unité de masse atomique est aussi appelée dalton (du nom de John Dalton) . On l’utilise pour quantifier le poids des molécules d’intérêt biologique .Son symbole d'unité est Da mais on utilise plus fréquemment le kDa (tout simplement parce qu’en biochimie on étudie plus souvent de grosses molécules comme par exemple des protéines)
Un dalton est avec une assez bonne précision la masse d'un atome d'hydrogène, la valeur exacte étant 1,00794 uma.
Note : on peut également retrouvé une autre notion, celle de la masse relative d'un élément.
La masse atomique relative d'un élément est définie comme le rapport entre la masse moyenne d'un atome pour la composition isotopique naturelle sur le douzième de la masse d'un atome de carbone.
Étude des masses des constituants de l'atome
- La masse d’un électron est de me = 9,1 x 10 -31 kg
- La masse d’un proton est de 1,673 x 10-27 kg
- La masse d’un neutron est de 1,675 x 10-27 kg
Si l’on souhaite estimer une masse avec 3 chiffres significatifs alors on peut faire l’approximation que le proton et le neutron ont une masse égale à environ 1,67 x 10 -27 kg.
Pour comparer la masse d’un nucléon et d’un électron on peut calculer le rapport de leur masse :
(1,67 x 10-27)/(9,1 x 10-31) = 1835
Un électron est près de 2000 fois plus léger qu’un nucléon: la masse d’un atome est donc concentrée dans son noyau et pour un calcul approché de masse il n’est pas nécessaire de tenir compte de la masse des électrons.
Calcul de la masse d'un atome 🏋️♂️

En tenant compte des approximations précédentes la masse d’un atome peut être calculée en négligeant les électrons et en considérant que les neutrons ont environ la même masse que les protons.
Pour calculer la masse d’un atome il suffit donc de multiplier son nombre de nucléons (A) par la masse d’un nucléon (soit 1,67 x 10-27 kg) :
Masse d’un atome = A x 1,67 x 10-27
Exemple : Calcul de la masse de l’isotope 12 du carbone.
Cet atome est constitué de 12 nucléons.
Sa masse est donc m = 12 x 1,67 x 10 -27 = 2,004 x 10 -26
La masse d’un atome de l’isotope 12 du carbone est donc de 2,004 x 10 -26 kg mol-1
Atomes, entre défauts de masse et énergie de liaison 💥
L’atome a une structure particulière, les scientifiques sont passés par différents stades avant d’arriver à décrire celle-ci. Le noyau d’un atome est constitué de protons et de neutrons, il est donc électriquement positif. Ce noyau est entouré d’électrons qui gravitent autour de celui-ci, la partie la plus extérieure de l’atome est donc électriquement négatif.
Défaut de masse d'un noyau
La masse d'un noyau est inférieure à la somme des masses des particules qui le composent. Le défaut de masse est cette différence. Elle est positive.
Défaut de masse :
[ Delta m = Z times m _ { p } + left( A - Z right) times m _ { n } - m _ { text { noyau } } ]
Énergie de liaison
Relation d'Einstein
⚡️ Le principe d'équivalence (1905), énergie-masse sont deux grandeurs proportionnelles et que de la masse peut se convertir en énergie et inversement. Toutes particules possèdent du fait de sa masse une énergie potentielle de repos.
[ E = m times c ^ { 2 } ]
Énergie de liaison
Elle est définie comme étant l'énergie qu'il faut fournir au noyau pour le dissocier en nucléons isolés et immobiles.
[ E _ { text { noyau } } + E _ { l } = E _ { text { proton } } + E _ { text { neutron } } ]
[ E _ { l } = E times m _ { p } times c ^ { 2 } + left( A - Z right) times m _ { n } times c ^ { 2 } - m _ { text { noyau } } times c ^ { 2 } ]
[ E _ { l } = c ^{ 2 } times left( left( Z times m _ { p } + left( A - Z right) times m _ { n } right) - m _ { text { noyau } } right) ]
[ E _ { l } = Delta m times c ^ { 2 } ]
Énergie de liaison par nucléon
Un nucléon correspond à un terme générique faisant référence aux différents composants d'un noyau atomique. En effet, par nucléon on sous-entend le terme proton et neutron qui sont tous deux ce qu'on appelle des baryons.
👉 De plus, il peut être intéressant de se souvenir que le nombre de nucléons d'un atome est, de façon générale, noté A et appelé nombre de masse
C'est l'énergie qu'il faut fournir au noyau pour le dissocier. Ces énergies de liaisons peuvent être calculées pour chaque noyau et on peut calculer pour chaque noyau son énergie de liaison par nucléon.
Atomes et transformations 🔬

Lorsque les atomes subissent des transformations (transformation en ion monoatomique ou lorsque qu'ils établissent des liaisons avec d'autres atomes) ils le font de façon à saturer leur couche externe.
La stabilité des atomes
Les atomes dont la couche externe est déjà saturée ne donneront donc pas d'ion monoatomique et n'auront pas tendance à établir de liaison avec d'autres atomes. Ils sont dits "chimiquement stables". On dit aussi qu'ils présentent une grande inertie chimique.
🔮 Cette fois-ci, c’est l’interaction électromagnétique entre le noyau et les électrons qui est responsable des mouvements des électrons autour du noyau d’un atome :
- Cette force agit sur tous les éléments qui ont une charge électrique
- Cette force peut être répulsive entre deux éléments de charges identiques (positif et positif, ou négatif et négatif)
- Ou attractive entre deux éléments de charges opposées (positif et négatif)
On dit que l’interaction électromagnétique est responsable de la cohésion des atomes, c’est-à-dire de la cohésion entre le noyau et les électrons.
Règle du duet
Au cours de leurs transformations chimiques, les atomes caractérisés par Z < 4 évoluent de manière à saturer leur couche (K).
Ils acquièrent un "duet" d'électrons c'est-à-dire une paire d'électrons.
Règle de l'octet
Au cours de leurs transformations chimiques, les atomes caractérisés par Z > 4 évoluent de manière à saturer leur couche externe (L) ou (M) etc... Ils acquièrent un "octet" d'électrons c'est-à-dire 8 électrons ou 4 paires d'électrons.
Il existe des exceptions à la règle de l'octet. Ces exceptions ne sont pas étudiées dans le cadre du cours de seconde.
Prévision de la charge des ions monoatomiques
🪫 L'application de ces règles permettent de prévoir la charge et donc la formule de la plupart des ions monoatomiques.
Par exemple : Considérons l'atome de chlore de numéro atomique Z=17 dont la formule électronique est : (K)2(L)8(M)7. Il possède 7 électrons sur sa couche externe (M). En se transformant en ion chlorure il sature cette couche externe avec un octet (8) électrons. Cet atome, initialement neutre du point de vue électrique, va donc gagner un électron c'est-à-dire une charge négative lors de sa transformation en ion chlorure. La formule de cet ion est alors : Cl-.
Atome et électronégativité
❌ Dans le domaine de la chimie, on décrit l'électronégativité comme étant une grandeur physique caractérisant la capacité d'un atome à attirer un ou plusieurs électrons lors de la formation d'une liaison chimique avec une autre espèce.
Selon leur configuration électronique, certains atomes capteront les électrons facilement alors que d'autres n'y arriveront pas. Par exemple, l'atome de fluor a pour configuration k2l7, il gagnera facilement un électron pour saturer la couche l.
La facilité des atomes à capter un électron s'appelle l'électronégativité. Dans le tableau périodique, les atomes les plus électronégatifs se trouvent en haut à droite.
Les isotopes des atomes
Chaque type d’atome est caractérisé par son nombre de protons qui lui est propre. Par exemple, tous les atomes de carbone contiennent 6 protons dans leur noyau. Ainsi, un atome contenant 6 protons est nécessairement un atome de carbone.
⚠️ Au contraire, un atome contenant un nombre différent de protons ne peut pas être un atome de carbone
En revanche, il peut y avoir des atomes avec le même nombre de protons mais avec des nombres de neutrons différents : on dit que ce sont des isotopes.
👉 Tous les isotopes du carbone ont donc 6 protons, mais ils peuvent avoir 6 neutrons, ou 7, ou 8 par exemple. Ainsi, pour un élément chimique donné, plusieurs isotopes peuvent être associés.
Des isotopes ont les mêmes propriétés chimiques mais leur stabilité peut être différente.
L'utilisation des atomes dans le cadre du nucléaire ☢️

🤯 On appelle radioactivité une réaction nucléaire spontanée au cours de laquelle un noyau atomique instable se désintègre en dégageant de l'énergie, sous forme d'un rayonnement électromagnétique, pour se transmuter en un noyau plus stable
Le phénomène de la radioactivité fut découvert en 1896 par Henry Becquerel sur l'uranium. Il avait entrepris de découvrir si un sel d'uranium phosphorescent émettait, en plus de la lumière, des rayons X (découvert par le physicien allemand, Wilhelm Röntgen en 1895). Il exposa ce sel au soleil avant de le placer à l'obscurité sur une plaque photographique. En étudiant ces plaques, il s'aperçut qu'elles étaient impressionnées même lorsque le sel d'uranium n'avait pas été exposé à la lumière du soleil. Il met également en évidence la présence de particules chargées, le matériau émet son propre rayonnement. Ce ne sont donc pas des rayons X, il nomme ces rayons, "rayons uraniques".
Fin 1897, Marie Skodowska-Curie qui était à l'époque étudiante choisit comme sujet de thèse l'étude de ce nouveau type de rayonnement. Elle entreprend de rechercher d'autres éléments pouvant produire un rayonnement semblable à celui du sel d'uranium phosphorescent. Elle découvre que des échantillons de minéraux d'uranium (la pechblende par exemple) sont plus actifs que l'uranium lui-même.
📖 En 1898, Marie Curie, aidée de son mari Pierre Curie, sépare chimiquement les éléments les plus actifs et isole ainsi le polonium puis le radium. Elle donne, en rapport avec ce dernier élément, le nom de "radioactivité" au phénomène.
En 1911, Marie Curie recevra le prix Nobel de chimie pour cette découverte ; c'est la seule femme à avoir reçue deux prix Nobel. En 1903, Pierre et Marie Curie ainsi qu'Henry Becquerel reçoivent le prix Nobel de physique pour la découverte de la radioactivité. Cette même année, des études menées par Henry Becquerel, Marie Curie, Paul Villard et Ernest Rutherford montrèrent l'existence de différents types de rayonnements, les rayonnements alpha (positifs), bêta (négatifs) et gamma (neutres). Ernest Rutherford découvrit également que la radioactivité s'accompagnait de la désintégration des éléments chimiques (transformation spontanée d'un élément en un autre), il énonça les lois fondamentales de ces transformations. E. Rutherford reçu en 1908 le prix Nobel de chimie.
🏆 Marie Skodowska-Curie est une physicienne et chimiste d’origine polonaise. Elle est très connue pour sa découverte de la radioactivité naturelle et des éléments 84 et 88 : le polonium et le radium. Elle reçut de multiples prix et distinctions pour ses recherches. Elle reçut en 1903 le prix Nobel de physique et en 1911 le prix Nobel de chimie. C’était la première femme à recevoir ce genre de distinction et encore à ce jour elle est la seule à en avoir reçu deux.
La radioactivité nucléaire
La radioactivité correspond à un phénomène physique au cours duquel des noyaux atomiques considérés comme instables, on les appelle alors radionucléides ou encore radioisotopes, se transforment, et ce de façon spontanée, en d’autres atomes tout en émettant par la même occasion des particules de matières comme des électrons, des noyaux d’hélium ou encore des neutrons et en émettant de l’énergie sous la forme de photons et d’énergie cinétique. On appelle cela une désintégration.
☢️ On appelle alors l’émission de particules, qu’elles soient matérielles ou immatérielles, rayonnement et on est capable de parler de rayonnements ionisants car l’énergie des particules est telle qu’elle est capable d’entraîner l’ionisation de la matière traversée. Il existe alors différents types de rayonnement, plus ou moins puissants. La radioactivité présente des effets sur les organismes subissant des rayonnements ionisants, on parle alors d’irradiation.
Cependant, ces effets dépendent du niveau, mais aussi de la durée de l’exposition, qui peut être aiguë ou encore chronique, de la nature du rayonnement mais également de la localisation de la radioactivité. En effet, les effets ne seront pas les mêmes si l’exposition est interne que si l’exposition était externe ou encore en surface. Les rayonnements provoqués par les substances radioactives sont très largement utilisés dans les différentes industries, notamment en ce qui concerne le contrôle de pièce manufacturées, les soudures, l’usure ou même à faible dose en médecine afin de déterminer un diagnostic ou dans une visée thérapeutique afin de soigner les cancers.
Dans tous les cas, il est évident qu’il est nécessaire de suivre des mesures de prévention, de protection mais également de contrôle qui resteront adaptés au niveau de radioactivité observé.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
comment déterminer avec précision la masse d’un neutron ou d’un proton ? est-ce par calcul ou par mesure de spectrographe de masse, ainsi pour dire que le neutron a une masse légèrement supérieure à celle du proton !!
Bonjour Mosbah, nous serions ravis de vous aider ! Rendez-vous sur la plateforme de Superprof, sélectionnez la rubrique « Découvrir nos Superprofs » en indiquant la matière souhaitée. Vous trouverez de nombreux professeurs près de chez vous. Bonne journée !
C’est possible d’avoir des exercices
J’ai besoin dés exercices sur ce cours si possible pour m’exercer
Radio activités
Bonjour,
Pour une aide personnalisée, vous pouvez contacter nos professeurs 🙂